[受験特集]薬学部入試のポイント
医歯薬予備校で化学を約20年担当、松本大地先生が入試のポイントを紹介!
2024年度 薬学部入試のポイント Vol.5
今回も前回に引き続き理論の中でも特に重要な酸化・還元とその応用である電気分解について説明したいと思います。
まず、酸化・還元です。物質の酸化・還元は酸素や水素のやりとりで定義(狭義の定義)されることもありますが、一般的には、酸化数*という数値を導入し、その増減により原子の酸化の程度を表します。
*酸化数とは成分原子の間に電子がどのように割り当てられるかを示すもので、ある原子が化合物中で他の原子に引き寄せられている価電子の数を表します。
原子の酸化数を求める場合、いくつかの規則がありますから、まず、それを覚えて下さい。
① 単体中の原子の酸化数は0とする。
② 化合物の構成原子の酸化数の総和は0とする。
③ 化合物中の水素原子の酸化数は+1、酸素原子の酸化数は-2、アルカリ金属の酸化数は+1、アルカリ土類金属の酸化数は+2とする。
④ 単原子イオンの酸化数はイオンの電荷に等しい。
⑤ 多原子イオンを構成する原子の酸化数の総和はイオンの電荷に等しい。
*例外としてH₂O₂のOの酸化数は-1、LiH(水素化リチウム)、NaH(水素化ナトリウム)のHの酸化数は-1。LiHやNaHはイオン結合をしており、H-は水素化物イオンと呼びます。
ここで重要な点は、イオン結合からなる化合物と共有結合からなる化合物とでは結合の仕方が異なるということです。例えば、イオン結合であるCuOであれば、Cu2+、O2-であるので、Cuの酸化数+2、Oの酸化数-2と電子の授受が電荷数に反映され、それが酸化数になっています。
それでは、共有結合からなる化合物の場合はどのように考えればよいでしょうか?例えば、H₂S(H-S-H)の場合、H-S間の共有電子対はイオン結合の場合と異なり、どちらか一方の原子に属するということはありません。しかし、このような共有結合からなる化合物でも共有電子対を電気陰性度の大きい元素に割り当て、イオン結合よりなる化合物のように考えて酸化数を求めます。H₂Sの場合、電気陰性度はS>Hですから、H+、S2-のように考えてHの酸化数は+1、Sの酸化数は-2となります。
次に、酸化剤と還元剤の反応式(半反応式)の作り方の手順を説明します。
① 酸化数の変化する部分を書く。(この部分だけを覚えておけば、以下の手順に従って半反応式を完成させることができます)
② e-を加える。(酸化剤は電子を奪うので左辺に、還元剤は電子を放出するので右辺に)
③ 両辺の電荷数をH +で合わす。(酸化剤の場合は左辺に、還元剤の場合は右辺に)
④ 両辺の原子数を合わす。
〈酸化剤の例〉
① MnO₄ - → Mn2+ ( Mn7+ → Mn2+ )
過マンガン酸イオン中でMn原子の酸化数は+7になっています。これは、Mnの価電子がO原子に奪われMn ⁷+になっていることを表しています。酸性状態でMnO₄-は強い酸化力を発揮し、Mn原子は還元剤より電子5個を奪い取りMn2+に変化します。(ちなみに、中性または塩基性では、MnO₄-はMnO₂(Mnの酸化数は+4)までしか還元されない)
② MnO₄- + 5e- → Mn2+
③ MnO₄ - + 8H+ + 5e- → Mn2+
④ MnO₄ - + 8H+ + 5e- → Mn2+ + 4H₂O ・・・ ⓐ
〈還元剤の例〉
(COOH)₂
① (COOH)₂ → 2CO₂ ( C³+ → C⁴+ )
シュウ酸分子中のC原子の酸化数は+3です。これは、C原子の価電子がO原子に奪われ、便宜上3価の陽イオンC ³+になっていると考えます。二酸化炭素中のC原子の酸化数は+4となり、C原子は電子1個を放出します。
② (COOH)₂ → 2CO₂ + 2e-
③ (COOH)₂ → 2CO₂ + 2e - + 2H+ ・・・ ⓑ
酸化還元反応式(イオン反応式)は酸化剤と還元剤のそれぞれの半反応式から電子を消去することで得られます。
ⓐ×2+ⓑ×5より
2MnO₄ - + 6H+ + 5(COOH)₂ → 2Mn2+ + 10CO₂ + 8H₂O
酸化還元反応を利用して、未知濃度の酸化剤または還元剤の濃度を求めることができます。これを酸化還元滴定と言います。
次は電気分解です。電解質の水溶液や融解液に電極を入れ、直流電源を通じて化学変化(酸化還元反応)を起こす操作を電気分解(電解)と言います。このとき、直流電源の正極につないだ電極を陽極、負極につないだ電極を陰極と言います。
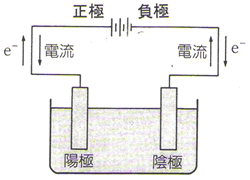
水溶液の電気分解では、水溶液中のイオンのうちイオン化傾向の小さいイオンから極で反応します。
それでは、各電極での反応をみていきましょう。
〔陰極〕
基本的にはイオン化傾向の小さい金属ほど反応しやすいと考えて下さい。ただし、Zn 2+~Pb2+の場合、条件(濃度や電圧)によって金属が析出する場合と水素が発生する場合があります。そのため、試験での出題はかなり少なくなりますが、過去には硫酸亜鉛水溶液等の電解が出題されたことがあります。また、さらにイオン化傾向の大きいK+~Al³+の場合は還元されることはなく、水溶液中の水の電離で生じたH+が還元(2H₂O+2e-→H₂+2OH-)されて、水素が発生します。
〔陽極〕
陽極では陰イオンが反応します。
陰イオンのイオン化列 NO₃-、SO₄2- > OH->Cl- > Br- > I-
この場合も上記のイオン化傾向の小さいイオンから反応(酸化)します。NO₃-やSO₄2-は陽極で反応することはありません。これは、各イオンを構成するN(酸化数+5)原子やS(酸化数+6)原子がすでに最高酸化数に達していますから、陽極でさらなる酸化がおこることはないのです。このような場合は水溶液中の水の電離で生じたOH-が酸化(2H₂O→O₂+4H++4e-)されて、酸素が発生します。
水溶液の電気分解において注意すべき点は、陽極の材質です。白金や炭素のように酸化されにくいものが使用されていれば、問題ありませんが、イオン化傾向がAg以上の金属が電極として用いられ、水溶液中にもその金属のイオンが含まれる場合、陽極自体が酸化されて水溶液中に溶け出します。溶け出した金属イオンは陰極上に析出します。このような原理を利用したのが電解精錬や金属めっきです。ちなみに、陰極では電子が送り込まれ、還元が起こりますから、鉄等の金属が極板として用いられても特に変化は起こりません。
























