[受験特集]薬学部入試のポイント
医歯薬予備校で化学を約20年担当、松本大地先生が入試のポイントを紹介!
2024年度 薬学部入試のポイント Vol.7
今回は化学の理論の中から入試で頻出の化学反応の速さと化学平衡について説明したいと思います。
まず、化学反応の速さから始めましょう。
1. 反応の速さの表し方
一般に反応の速さは反応物または生成物の単位時間におけるモル濃度[mol/L]の変化量で表されます。
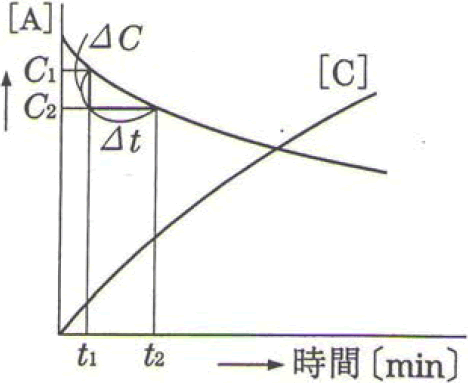
例えば、 A + B→ 2C
の反応において反応物Aの濃度[A]と生成物Cの濃度[C]の時間変化を右図で表します。
時間t₁[min]のときの[A]がC₁[mol/L]t₂[min]のときの[A]がC₂[mol/L]の場合、平均の反応速度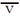 (A)は
(A)は
【-の符号の意味】反応物Aの濃度変化⊿C<0であるため、速度の値を正にするために-の符号を付けます。反応速度はつねに正の数で表します。濃度が増加(⊿C>0)する場合は-の符号は必要ありません。
生成物Cの増加で反応速度を表した場合、A1molの減少によりCは2mol生成しますから、Cの生成速度 (C)は
(C)は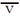 (A)の2倍になります。このように同じ反応でも着目する物質によって反応速度は異なった値になります。
(A)の2倍になります。このように同じ反応でも着目する物質によって反応速度は異なった値になります。
2. 反応速度式
反応の速さと反応物の濃度の関係を表す式を反応速度式といいます。
例えば、 aA + bB → cC 上記の反応ではCの生成速度vを
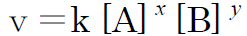
と表すことができます。ここで、x+yを反応次数といいます。このx、yの値は化学反応式の係数a、bとは必ずしも一致するものではなく、実験により求められるものです。
実験データよりx、yの値がどのようにして決められるのかを見ていきましょう。
■ 次の表の実験1と2を見て下さい。Aの濃度を一定にしてBの濃度を0.70から1.40へ2倍にした場合(実験2→実験1)、Cの生成速度は5.0×10⁻³から2.0×10⁻²へと4倍に増加しています。この実験結果はCの生成速度vがBの濃度の2乗に比例していることを示しています。また、Bの濃度を一定にしてAの濃度を0.40から0.80へ2倍にした場合(実験2→実験3)、Cの生成速度は5.0×10⁻³から1.0×10⁻²へと2倍に増加しています。これはCの生成速度vがAの濃度に比例していることをしめします。
| 実験 | [A] [mol/L] | [B] [mol/L] | v [mol/(L・S)] |
|---|---|---|---|
| 1 | 0.40 | 1.40 | 2.0×10⁻² |
| 2 | 0.40 | 0.70 | 5.0×10⁻³ |
| 3 | 0.80 | 0.70 | 1.0×10⁻² |
したがって、Cの生成速度vは
v=k [A][B]²
と表されます。
*一般的に反応速度式のように直感的に理解しにくいものは、それに関する問題を解くことによって理解を深めることができますから、化学だけに限らず出来るだけ多くの問題を解くようにして下さい。
3. 化学平衡
化学反応において、正反応の速さと逆反応の速さが等しくなった状態を平衡状態といいます。この状態は正反応も逆反応もおこらず、反応そのものが停止している状態ではありませんので、注意して下さい。
それでは、ここで平衡状態において成り立つ関係について調べていきましょう。
aA + bB ⇆ cC + dD
上の反応が化学平衡の状態にあるとします。正反応の速さをv₁、速度定数をk₁、逆反応の速さをv₂、速度定数をk₂とすると
v₁=k₁[A]a[B]b
v₂=k₂[C]c [D]d
平衡状態になったとき、v₁=v₂であるから、k₁[A]a [B]b =k₂[C]c [D]d より
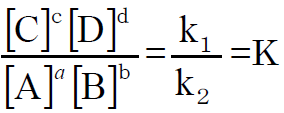
この関係を質量作用の法則、Kを平衡定数といいます。ちなみに、上記の反応の速さv₁、v₂は反応次数の部分が化学反応式の係数によって表されていますので、必ずしも正しいものではありませんが、導き出された平衡定数が正しいことは証明されています。
気体反応の場合は、モル濃度の代わりに分圧を用いて次のように平衡定数を表すことができます。
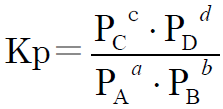
このKpを圧平衡定数といいます。
4. 電離平衡
弱酸・弱塩基を溶かした水溶液中では一部が電離して、平衡状態に達します。この状態は電離平衡といい、分子やイオンの濃度の間で質量作用の法則が成り立ちます。
C [mol/L]のアンモニア(弱塩基、電離度α≪1)を例にして、電離定数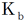 を求めてみましょう。
を求めてみましょう。
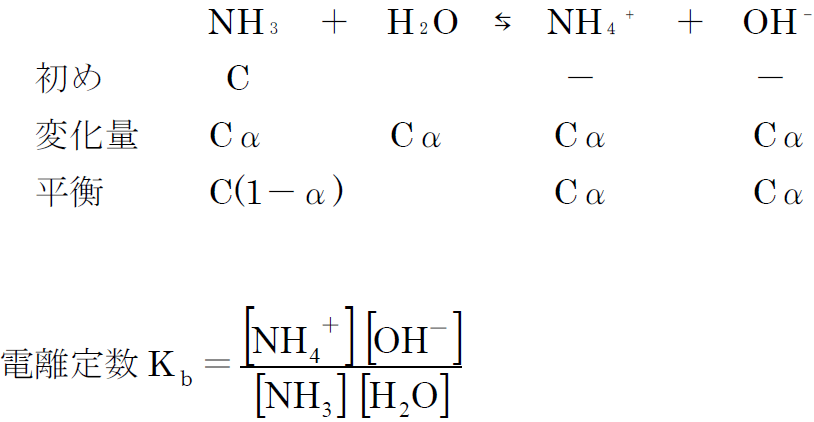
ここで、[H₂O]は水の濃度を表していますが、水の濃度って、ちょっと意味が分かりませんよね。でも、単位から考えれば[mol/L]ですから、水溶液1L中の水のモル数ということになります。希薄溶液の場合、水溶液1Lの水の質量は1000gと近似できますから、その水の物質量は![]() ≒55.6mol、したがって、[H₂O]≒55.6[mol/L]となります。Cαは非常に小さい数ですから、上の反応によって[H₂O]の値はほとんど変化せず、常に一定とみなすことができます。
≒55.6mol、したがって、[H₂O]≒55.6[mol/L]となります。Cαは非常に小さい数ですから、上の反応によって[H₂O]の値はほとんど変化せず、常に一定とみなすことができます。
よって、
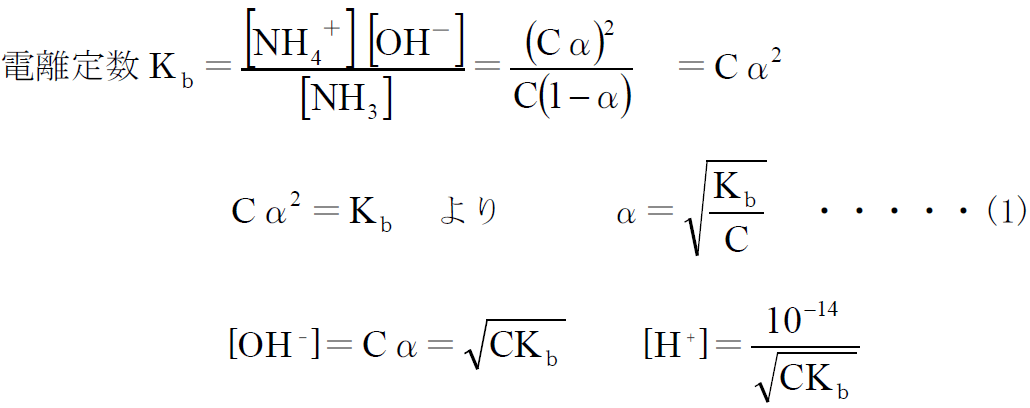
酸・塩基の分野では、電離度と濃度の関係については説明されていませんが、(1)式から電離度は濃度の平方根に反比例することがわかります。模試や入試では、酢酸の電離平衡は頻出問題です。ちなみに、酢酸の電離定数を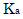 とすれば、電離度αは(1)と同じ式になりますので、必ず導けるようにして下さい。
とすれば、電離度αは(1)と同じ式になりますので、必ず導けるようにして下さい。
























