[受験特集]薬学部入試のポイント
医歯薬予備校で化学を約20年担当、松本大地先生が入試のポイントを紹介!
2024年度 薬学部入試のポイント Vol.8
今回は無機化学について学習しましょう。
①非金属元素 ②典型金属元素 ③遷移金属元素 ④金属イオンの反応の4つの項目に分けて重要なポイントに的を絞り、説明したいと思います。
まず、①非金属元素については、気体の製法(捕集法・乾燥剤等を含む)とそれらの性質を整理して覚えて下さい。重要な気体はいくつかありますが、特に塩素の製法については、発生装置を含めた出題は頻出であるため、下にMnO₂に濃塩酸を加え加熱することにより塩素を発生させる装置の図を示しポイントを指摘したいと思います。
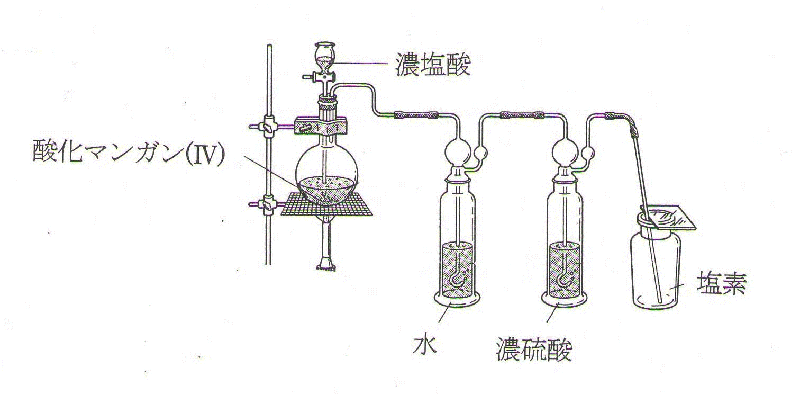
バーナーで加熱することで反応を盛んにし、塩素を発生させますが、そのとき、そもそも気体である塩化水素が水に溶けた塩酸は加熱により溶解度が小さくなり、塩化水素の気体となり塩素とともに多量に発生することに注意して下さい。そして、それらの気体と水蒸気は、水の入った洗気びんを通ることで、まず、塩化水素が除去されます。塩素と水蒸気はそのまま通過し、次の濃硫酸(酸性の乾燥剤)の入った洗気びん中で水蒸気が除去され、塩素は下方置換で捕集されます。(2つの洗気びんの順番やその理由は定期テストや入試でも頻出問題です)塩素のような酸性気体や塩基性気体は一般に水に溶けますから、水上置換で捕集することはできず、上方置換または下方置換で捕集します。
その他、気体の製法で発生装置とともに出題されるのは、アンモニアとキップの装置による二酸化炭素です。これらにつきましては、教科書や図説等で確認しておいて下さい。気体の乾燥(不純物としての水蒸気の除去)については、気体と乾燥剤の適合性を考えなければなりません。すなわち、基本的には乾燥剤は乾燥させる気体と反応しないものを選びます。
酸性の気体・・・・酸性または中性の乾燥剤
塩基性の気体・・・塩基性または中性の乾燥剤
中性の気体・・・・どの乾燥剤でも適す
ここで、例外として試験によく出るのはH₂S(酸性気体)に濃硫酸(酸性)が使えないことです。これは、
H₂S + H₂SO₄ → SO₂ +S +2H₂O
上記のようにH₂SとH₂SO₄が酸化還元反応を起こしてしまうからです。また、NH₃はCaCl₂(中性)を乾燥剤として使うことはできません。これは、CaCl₂にNH₃が吸着(CaCl₂・8NH₃)されるからです。
その他、非金属化合物の製法に関する問題としては、接触法による濃硫酸の製法やオストワルト法による硝酸の製法がよく出題されます。気体を発生させる際に使用される触媒があれば、それも必ず覚えて下さい。
次に、②典型金属元素 ③遷移金属元素 これらの酸化物について考えてみましょう。
まず、一般に金属の酸化物は塩基性酸化物に分類されます。これは、化合物中に酸化物イオンO²⁻があり、酸と反応するからです。
O²⁻ + 2H⁺ → H₂O
例) CaO + 2HCl → CaCl₂ + H₂O
注意すべき金属として、Al、Zn、Sn、Pb等の両性金属の単体及び酸化物・水酸化物です。これらは、すべて酸とも塩基とも反応します。Alを例にして単体・酸化物・水酸化物がどのように反応するかを調べてみましょう。
例) AlとHClの反応
イオン化傾向がAl>Hであるため、イオン化傾向の大きいAlが酸に溶けます。
2Al + 6HCl → 2AlCl₃ + 3H₂
例) AlとNaOHの反応
AlはOH⁻と錯イオンを形成して溶けます。
2Al + 2NaOH + 6H₂O → Na[Al(OH)₄] + 3H₂
例) Al₂O₃とHClの反応
上で説明したように金属の酸化物は塩基性酸化物なので酸と反応します。
Al₂O₃ + 6HCl → 2HCl → 2AlCl₃ + 3H₂O
例) Al₂O₃とNaOHの反応
通常金属の酸化物は塩基性であるため、塩基とは反応しませんが、Al³⁺がOH⁻と錯イオンを形成するため反応が進みます。
Al₂O₃ + 2NaOH + 3H₂O → 2Na[Al(OH)₄]
例) AI(OH)₃とHClの反応
中和反応が起こります。
Al(OH)₃ + 3HCl → AlCl₃ + 3H₃O
例) Al(OH)₃とNaOHの反応
通常金属の水酸化物は塩基であるため、塩基とは反応しませんが、Al³⁺はOH⁻と錯イオンを形成しますから反応が進みます。
Al(OH)₃ + NaOH → Na[Al(OH)₄]
最後に④金属イオンの反応について考えます。ここでは、特に重要なOH⁻とS²⁻で沈殿する金属イオンをイオン化傾向と関連づけて調べてみましょう。

■ 水酸化物が沈殿(1)
① 多量のNH₃水を加えると錯イオンをつくって再び溶解するもの。
Zn(OH)₂ 白色 → [Zn(NH₃)]²⁺ 無色
Cu(OH)₂ 青白色 → [Cu(NH₃)₄]²⁺ 深青色
Ag₂O 褐色 → [Ag(NH₃)₂]⁺ 無色
② 多量のNaOH水溶液を加えると錯イオンをつくって再び溶解するもの。
Zn(OH)₂ 白色 → [Zn(OH)₄]²⁻ 無色
Al(OH)₃ 白色 → [Al(OH)₄]⁻ 無色
Pb(OH)₂ 白色 → [Pb(OH)₄] 無色
*この場合の金属イオンは両性金属
■ 酸化物が沈殿(2)
常温で水酸化物の分解反応(脱水)が起こり酸化物が生成します。
2Ag⁺ + 2OH⁻ → 2AgOH → Ag₂O↓ + H₂O
■ 硫化物による沈殿(酸性では沈殿しない(3)・酸性で沈殿する(4))
硫化水素は水溶液中で下に示す平衡状態にあります。
H₂S ⇌ 2H⁺ + S²⁻ ・・・(a)
① 酸性では沈殿しない(3)
イオン化傾向が中程度の金属イオンは水溶液中で比較的安定にイオンとして存在できるため、S²⁻の濃度がある程度大きくなければ、硫化物として沈殿しません。(a)の平衡の式では塩基性(または中性)にすることでH⁺を中和し、平衡を右に移動することでS²⁻の濃度を大きくし、金属イオンを硫化物の沈殿として生成させることが可能となります。
② 酸性で沈殿する(4)
酸性溶液中では(a)の平衡は左に大きく片寄り、S²⁻の濃度は非常に小さくなりますから、水溶液中でイオン化しにくいSn²⁺よりイオン化傾向が小さいイオンのみを沈殿させます。
























