[受験特集]薬学部入試のポイント
医歯薬予備校で化学を約20年担当、松本大地先生が入試のポイントを紹介!
2024年度 薬学部入試のポイント Vol.4
今回は理論化学の中でも重要な位置を占める酸・塩基と中和反応について説明したいと思います。
① 酸・塩基の定義
▼図表はタップすると拡縮が可能になります。
② 酸・塩基の強弱
酸・塩基の強弱は、電離度(α)によって決まります。すなわち、αが大きい(1に近い)も のが強酸(強塩基)であり、αが小さい(0に近い)ものが弱酸(弱塩基)となります。

下の強酸と強塩基を覚えておけば、良いでしょう。その他は弱酸・弱塩基となりますから。
| 強酸 | HCl、HBr、HI、HNO₃、H₂SO₄ |
|---|---|
| 強塩基 | アルカリ金属の水酸化物(LiOH、NaOH等) アルカリ土類金属の水酸化物(Ca(OH)₂、Ba(OH)₂等) |
〈捕捉①〉HNO₃、H₂SO₄以外はハロゲン化水素です。HFは水素結合により数個の分子 が会合しています。したがって、水素結合に関与して会合分子(一つのかたまり)を 作っている状態では、H原子は電離できませんから、電離度が小さくなるのです。
*5月号でも触れましたが、HFが弱酸であることは、会合説以外の考え方で説明されることもあります。
〈捕捉②〉上の電離度を表す式において、分母は溶かした電解質~となっていますが、塩基の場合NH₃(分子)を除くと、すべてイオン結合をしていますから、溶けた物質はすべて電離します。ですから、上の式は塩基については、少し正確さを欠いた表現になっています。したがって、水によく溶ける塩基が強塩基であると考えればよいでしょう。ちなみに、水によく溶ける塩基をアルカリといいます。
〈捕捉③〉酸・塩基の強弱は、後に学習する塩が加水分解したときの水溶液の液性に関係しますので、必ず覚えておいて下さい。
③ 中和反応の量的関係
酸と塩基が過不足なく完全に中和するとき
酸のH⁺の物質量 = 塩基のOH⁻の物質量
上の関係式が成り立ちます。例えば、1〔mol/L〕のNaOH(強塩基、α=1とする)水溶液1〔L〕中には、OH⁻は1mol存在しますが、これを中和するとき1〔mol/L〕のHCl(強酸、α=1とする)は1〔L〕必要となります。それでは、1mol/LのCH₃COOH(弱酸、α=0.01)水溶液では何〔L〕必要でしょうか?答はこの場合も1〔L〕です。
1〔L〕のCH₃COOH水溶液中にはH⁺は0.01molしか存在しませんが、その0.01molのH⁺が0.01molのOH⁻と反応してH₂Oが生成し、いったんH⁺が0となると考えます。しかし、CH₃COOH水溶液中の未反応のCH₃COOH分子(0.99mol)がすぐにその100分の1だけ電離し、再びOH⁻と反応しH₂Oを生成し、また、H⁺は0となりますが、すぐに未反応のCH₃COOH分子がその100分の1だけ電離して・・・このような反応が便宜上繰り返されていると考えると、結局、電離度α=0.01のCH₃COOH水溶液であっても1〔L〕中のCH₃COOH分子が1molのH⁺を放出することになります。したがって、中和反応の量的関係においては電離度は関係なく、酸・塩基の水溶液どうしの反応では次の公式が成り立ちます。
▼数式はタップすると拡縮が可能になります。
ただし、強塩基を強酸で中和した場合と弱酸で中和した場合とでは中和点での液性が異なります。すなわち、前者の場合、水溶液は中性となりますが、後者の場合は生成した塩の加水分解により弱塩基となります。
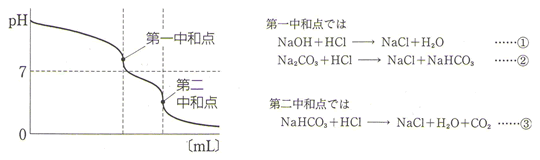
最後に少し難しくなりますが、NaOHとNa₂CO₃の混合物をHClで滴定する場合を考えてみましょう。
この滴定においては、下の3つの反応(①、②、③)が起こります。
▼図式はタップすると拡縮が可能になります。
問題集や参考書によっては、第一中和点において①、②の反応が同時に完結するかのような曖昧な表現になっているものをしばしば見かけますが、実際には①の反応、すなわち、NaOHのOH⁻とH⁺の中和は3つの中和反応のなかで最も速く反応が進みます。したがって、①の反応が終了した時点で大半のNa₂CO₃は中和されず、未反応のNa₂CO₃の加水分解により、水溶液はかなり強い塩基性になっています。そのため、①の中和反応による急激なpHの変化、いわゆる、pHジャンプは認められず滴定曲線はなだらかな右下がりの曲線になっているのです。
第一中和点は②の反応の終点を表しています。この中和点では生成したNaHCO₃の加水分解により、水溶液はわずかに塩基性になっています。第一中和点以降に滴下されたHClは③の中和反応に使われ、③の反応の終点が第二中和点になります。第一中和点から第二中和点のあいだに滴下したHClの物質量は③の反応式よりNaHCO₃の物質量、すなわちNa₂CO₃と等しくなります。
上の例は定性的な解説になっていますが、内容をよく理解して頂ければNaOHやNa₂CO₃の物質量を求める計算問題も簡単に解けると思います。入試や模試にはよく出題されますから、ぜひ、チャレンジして下さい。
また、「化学」のなかでは電離平衡を学習します。内容は少し難しくなりますが、まず、酢酸の電離平衡をよく理解して、電離度や酸の濃度を導けるようにして下さい。定期テストでは必ず出題されますが、模試や入試でも頻出分野です。