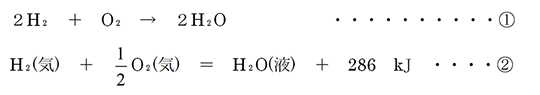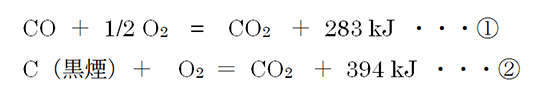[受験特集]薬学部入試のポイント
医歯薬予備校で化学を約20年担当、松本大地先生が入試のポイントを紹介!
2024年度 薬学部入試のポイント Vol.6
今回は化学反応と熱(熱化学)について説明したいと思います。みなさんは化学反応式と熱化学方程式の違いを正しく理解していますか?もし、自信がなければ、まず、Vol.3で説明した物質量及び化学反応式の量的関係を復習して下さい。
ここでは、水素が燃焼して水が生成する場合を例にとってそれらの相違点を考えてみましょう。
▼数式はタップすると拡縮が可能になります。
①が化学反応式、②が熱化学方程式ですね。①と②の違いは係数、左辺と右辺をつなぐ記号(→と=)、物質の状態の表記の有無、熱量(反応熱)の表記の有無です。いくつかの相違点がありますが、最も重要なポイントは化学反応式はその係数が反応にかかわる物質(反応物、生成物)の物質量(数)の比を表している(したがって係数は整数で表す)のに対して、熱化学方程式はその係数が物質量そのものを表している点です。すなわち、②の式は気体のH₂分子1molと気体のO₂分子0.5molが反応して、液体のH₂O分子が1mol生成し、そのとき286 kJの熱が放出(発熱)されることを表しています。(したがって286kJ/molと表記する必要はありません)また、みなさんはあまり意識されていないかも知れませんが、熱化学方程式中の化学式(H₂、O₂等)は単に物質の種類を表しているだけでなく、その物質がもつエネルギー量も表しています。等式の両辺は同じ物理量でなければなりませんから、右辺の1つの項にkJ単位のエネルギーがあると言うことは、両辺の化学式も本来エネルギーの単位をもっていることになります。ちなみに、H₂分子がもつエネルギーは主に結合エネルギーですが、その他にも、運動エネルギーや分子間力による位置エネルギー等が考えられます。
①の化学反応式について念の為に補足すれば、2H₂やO₂はH₂分子が2mol、O₂分子が1mol反応すると考えることができますが、H₂分子が2個、O₂分子が1個反応すると考えても構わないのです。要するに、上述のように反応式の係数は物質量そのものを表しているのではなく、反応する物質の比を表しているのです。
●反応熱の種類
反応熱には、燃焼熱、生成熱、中和熱、溶解熱がありますが、間違いやすいものとして、生成熱(物質1molがその成分元素の単体から生成)があります。
▼数式はタップすると拡縮が可能になります。
①、②式では、ともにCO₂が生じていますが、①式では反応物のCOは化合物ですから、①式はCO₂の生成熱を表す熱化学方程式ではありません。
*ちなみに、中和熱は、酸と塩基の中和により水1molを生じる(H++OH- → H₂O)ときに発生する熱ですから、強酸と強塩基の中和反応では酸・塩基の種類に関係なく、ほぼ56kJです。
―ヘスの法則とその利用―
“反応熱は反応の経路によらず、反応のはじめの状態と終わりの状態だけで決まる”と言うのがヘスの法則です。
例えば、一酸化炭素の生成熱を実験より求めようとすれば、黒鉛を不完全燃焼させてすべてをCOの段階で止めなければなりませんが、実際には完全燃焼したCO₂が同時に生成してしまいますから、COの生成熱を測定することは困難です。そこで、ヘスの法則を利用します。下の図を見て下さい。
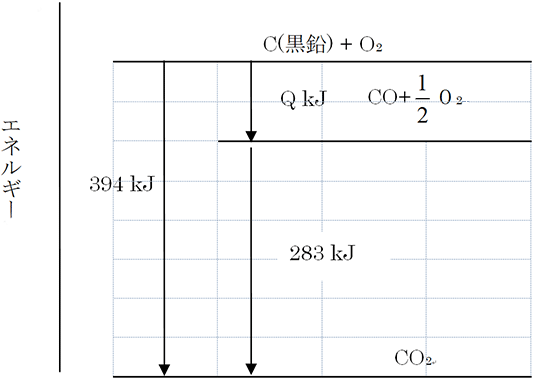
この図で、はじめの状態はC(黒鉛)+O₂、終わりの状態はCO₂です。図は、はじめの状態から直接終わりの状態へ反応が進めば394kJの熱が放出されること、また、いったんCOが発生し、それが燃焼してCO₂が生成する2つの経路が示されています。ヘスの法則によれば、394kJと(Q+283)kJが等しいことになります。よって、COの生成熱Qは111(=394-283)kJとなります。
このようにヘスの法則を利用すると、実験では求めることが難しい反応熱も計算により求めることができます。