[受験特集]薬学部入試のポイント
医歯薬予備校で化学を約20年担当、松本大地先生が入試のポイントを紹介!
2024年度 薬学部入試のポイント Vol.2
今回からいよいよ薬学部受験対策(化学編)に入りたいと思いますが、その前に前回のコラムで触れた入試科目について、もう少しお話しいたします。入試の多様化という名目で現在、薬学部入試においても化学が必須でない大学も珍しくありません。話は少しそれますが、工学部の建築学科や機械学科でも生物で受験できる大学もあります。しかし、それらの学科で物理の知識がまったくなければ、大学の授業についていけません。それと同じように薬学部において化学の知識は必須なのです。このコラムを読んで頂いている生徒のみなさんには、ぜひ入試科目として化学を選択して頂き、将来の薬学部生としての基礎を築いて頂きたいと思います。万一、他の科目で受験する場合でも化学の重要性を認識して、学校での授業は化学基礎だけでなく、化学(特に有機化学)までしっかりと取り組んで下さい。
それでは、本題に入りましょう。化学は一言で言えば、“物質を扱う学問”ということができます。したがって、その物質の構造(結合状態)、化学的および物理的性質を知ることが化学学習の本質であり、受験化学もその例外ではありません。そこで、1回目の今回は、原子の構造・周期表等、物質の構造(化学結合)・性質を理解する上で必要不可欠な知識の整理を行いたいと思います。
まず、原子の構造・電子配置及び周期表について考えてみましょう。この分野は、入試問題としても頻出ですが、受験生の皆さんが、まもなく受ける模試においても毎回必ず出題されます(特に小問集合問題として出題される場合が多い)。盲点をつく問題が多く、意外に苦戦を強いられる分野でもありますから、しっかりと理解して下さい。
まず、周期表は原子番号20のCaまでは元素記号と原子番号が一致するように覚えて下さい。(例えば、硫黄の元素記号はSで原子番号は16といった具合です。質量数(=陽子数+中性子数)や中性子の数を問われる問題が多いですから) 次に、アルカリ金属・アルカリ土類金属(BeとMgを除く2族)・ハロゲン・希ガス・14族元素(たんす(C)の下(Si)には現金(Ge)すず(Sn)なり(Pb))のように性質が似ている族ごとに覚えて下さい。
遷移元素については、3~11族に位置すること、あとできれば、第4周期の元素については覚えておいた方がよいでしょう。典型元素か遷移元素かを区別するような典型的な知識問題も入試で出題されることがあります。
周期律(原子番号順に元素を並べると、その性質が周期的に変化すること)に関する問題はグラフと関連づけたものが多く出題されます。特に
- 典型元素の価電子の数
その族番号または族番号-10に等しい。0~7の値をとる。 - 第1イオン化エネルギー
族を下へいくほど小さく、右へいくほど大きくなる。同周期では希ガスが最大。 - 電気陰性度
周期表の右上ほど大きい。最大値F>O>N。ただし、希ガスは除く。
*知識問題では例外をしっかりと覚える!
上記の物性がどのように変化するかを覚えて下さい。ちなみに、価電子とは最外殻に存在し他の原子との結合に関与する電子のことですから、希ガスの場合、最外殻に8個(Heは2個)の電子が存在しても、それらは安定な電子配置であり化合物を作りにくいことから、価電子としては0になります。ただし、1962年以降、Xe キセノンの化合物であるXeF₂(二フッ化キセノン)、XeF₄(四フッ化キセノン)などが合成されています。
また、電子殻に収容される電子の最大数が2n²(n=1,2,3‥)であることから、例えば、n=3(M殻)のとき、最外殻には最大18個の電子が収容されると勘違いしている生徒がいますが、8個を超えた場合、次のN殻(n=4)に収容されます。最外殻に9個以上の電子が存在することはありません。従って、最外殻に8個の電子が存在する希ガスの価電子の数が0ですから、価電子は0~7の整数値となります。教科書や参考書には原子の電子配置の表がありますから、確認してみて下さい。
受験生の皆さんがよく間違える問題としては、典型元素では、一般に原子半径は同周期を右へいくほど小さくなります。(希ガスは除く) これは、核の陽子の数の増加にともない最外殻の電子が強く引きつけられるからです。
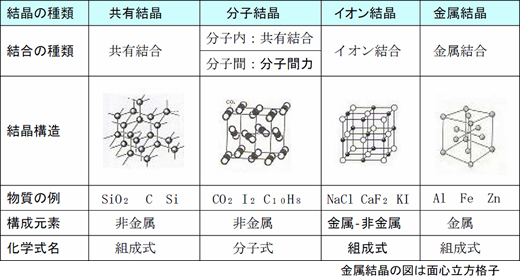
次に、物質(結晶)の構造・結合等について調べてみましょう。
※画像をクリックすると拡大します
上の表の中で分子間力とは、ファンデルワールス力、極性分子間に働く引力、水素結合をさします。分子間力は共有結合・イオン結合・金属結合に比べると、きわめて弱い力であるため、分子間力により形成される結晶はやわらかく、融点・沸点は低くなります。ただし、ファンデルワールス力に比べると、水素結合は分子間に強くはたらくため、物質の融点や沸点を高めます。入試問題でも水素結合に関する出題は多く、例えば、15~17族の水素化合物のうち、電気陰性度の大きいF、O、Nの水素化合物、すなわち、HF、H₂O、NH₃は同族の水素化合物より沸点が高くなる・・また、ハロゲン化水素酸(HCl、HBr、HI)は強酸ですが、フッ化水素酸は数個の分子が水素結合により会合分子をつくっているため、分子間にはさまれたH原子は電離しにくく、電離度が小さくなり、弱酸となる・・等。(下線部については、会合分子説以外の説明もあります)
また、ある物質が分子であるのかイオン結晶からなる物質であるのかを問われることがあります。分子性物質は、共有結晶(SiO₂、C、Si等。例は少ない)を除く非金属元素で構成された物質ですから、化学式から判断できます。ちなみに、イオン結晶は金属と非金属より構成されており、分子ではありませんから、化学式名は分子式ではなく、組成式といいます。(組成式NaClは、Na1個とCl1個からできた塊(分子)ではなく、Na:Cl=1:1、すなわち、結晶中の各原子の数の割合が1:1であることを表しています)
上の表の結晶構造の図を参考にして、各結晶がどのような結合力により結びついているのか、また、構成元素や具体的な結晶の例等をしっかりと頭に入れてください。