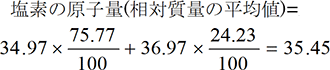[受験特集]薬学部入試のポイント
医歯薬予備校で化学を約20年担当、松本大地先生が入試のポイントを紹介!
2019年度 薬学部入試のポイント Vol.3
こんにちは、今回は化学計算の基礎となる原子量や物質量及び化学反応式の量的関係について説明したいと思います。
まず、元素の原子量がどのように決められているかを考えてみましょう。下の表に示すように例えば炭素や塩素原子1個の質量はきわめて小さく扱いにくいものです。そこで、¹²Cの質量を基準(12)とした相対質量を各原子について定めます。下表より³⁵Clの相対質量は34.97となります。仮にClに同位体が存在しなければ、相対質量34.97がそのまま塩素の原子量になります。
▼表組みは横にフリックすることが出来ます
| 原子 | 原子1個の質量 | 原子の相対質量 |
|---|---|---|
| ¹²Ⅽ | 1.993×10⁻²³〔g〕 | 12 |
| ³⁵Cl | 5.808×10⁻²³〔g〕 | 34.97 |
³⁵Clの相対質量をXとすると
1.993×10⁻²³:5.808×10⁻²³=12:X X = 34.97
しかし、実際の塩素には下に示すように³⁵Clと³⁷Clの同位体が存在しますから、それらの存在比を考慮した相対質量の平均値が塩素の原子量になります。ちなみに、周期表の炭素の原子量も同位体が存在するため12.01となっています。また、原子量は質量そのものではなく、¹²Cの質量を基準(12)にした相対値であるため単位のない無名数(むめいすう)となります。
◆元素と原子
ところで、皆さんは元素と原子の違いを説明できますか?
化学においては、イロハのような質問ですが、意外に教書や参考書にも良い説明がありません。
簡単に言えば、陽子の数によって決まる粒子が元素です。現在のところ100余りの元素が存在します(人工的に合成されるものを含む)。例えば、水素元素と言えば、1個の陽子を持つ元素ですが、その中に中性子の数が異なる粒子(同位体)が存在しますが、それらが原子です。ですから、水素原子は ¹H~³H(天然に存在)、⁴H~⁷H(天然には存在せず、合成による)の7種類が存在することになります。ちなみに、原子は3000~6000種類存在すると言われています。
次に、物質量の単位〔mol〕について説明しましょう。molが出てくるあたりから、“化学が分からなくなってしまった”という声を耳にすることがありますが、実際にはmolそのものは、きわめて理解しやすい概念です。すなわち、1molとは粒子(原子・分子・イオン等)が6.02×10²³個集まった集団の単位に過ぎません。よく例に出されるように鉛筆が12本あれば、1ダースというのと同じで、水素分子1molといえば、H₂(2原子分子)が粒子として6.02×10²³個存在するという意味です。ただし、分子を構成するH原子の数は2mol、すなわち、2×6.02×10²³個になります。
それでは、6.02×10²³という数(アボガドロ数)はどこから出てきたのでしょうか。その答えは原子量の基準を¹²C=12としたところにあります。すなわち、アボガドロ数とは¹²Ⅽ原子12〔g〕中の¹²C原子の数なのです。(12÷1.993×10⁻²³で得られます)
アボガドロ数=6.02×10²³
このように、¹²C=12を原子量の基準とし、アボガドロ数個の粒子の集団を1molと定義することによって、例えば、Cl₂(分子量71)1molの質量は71〔g〕、NaCl(式量58.5)1molの質量は58.5〔g〕と、分子量や式量に〔g〕をつけた数が物質1molの質量となります。
次に、化学反応式が表す意味について考えてみましょう。
▼表組みは横にフリックすることが出来ます
| 化学反応式 | 2NO | + | O₂ | → | 2NO₂ |
|---|---|---|---|---|---|
| 分子数 | 2分子 | 1分子 | 2分子 | ||
| 2×6.02×10²³個 | 6.02×10²³個 | 2×6.02×10²³個 | |||
| 物質量 | 2mol | 1mol | 2mol | ||
| 質 量 | 2×30g | 32g | 2×46 g | ||
| 体 積* | 2×22.4L | 22.4L | 2×22.4L |
*(0℃、1013hPa)
上に示す化学反応式より、反応式の係数の比が物質量(mol)の比を表していることが分かります。また、反応物(反応式の左辺にある物質)の質量の和と生成物(反応式の右辺にある物質)の質量が等しい(質量保存の法則)ことが分かります。さらに、上の反応のように反応物及び生成物が気体であれば、係数の比は反応する気体の体積の比に等しくなっています。
化学反応式に基づく計算問題は基本的には比例計算を解いているに過ぎません。比例計算ができない人はいないと思いますから、上の反応式で量的関係を理解すれば、後は化学反応式さえ作ることができれば、どのような計算問題でも解けるはずです。